電気分解や電池といったテーマは、入試でもよく出題されます。
でも「陽極?陰極?聞きなれない単語も多いしイメージがわかない…」と、つまづく人も多いのが電気分解。
電気分解を理解するコツは、イメージしづらいからこそ頭の中だけで考えず「図を描いて考える」こと。
図示の仕方を学んで、電気分解への苦手意識を払拭しましょう!
電気分解とは
化学変化によって電気エネルギーを取り出すのが電池。
その逆で、電気エネルギーによって化合物を分解するのが電気分解です。
例えば、水は加熱したり冷却したりしても水のままで、熱エネルギーでは分解できない安定した物質です。
でも、電気エネルギーを加えることで、水素と酸素に分解できましたね。
これが電気分解です。
電気分解を解く上で覚えておきたいポイント!
中2で習う水の電気分解では、実験結果をもとに水素と酸素が発生したことを学びました。
これは実験結果から明らかになったことで、電気分解の過程で何が起こっているかは考えない、いわば暗記に頼ったものでした。
しかし中3の範囲では電気分解する電解質の種類が増えるので、暗記だけに頼ると混同してしまいがちです。
そこで、「電気分解で何が起こっているのかを理解して図と化学反応式に書きおこす」のがポイントです。
面倒くさそうに思えますが、きちんと書き出すことに慣れてしまえば丸暗記より楽な上、ミスも防げます。
では、図と化学反応式を書き出す手順に沿って、ポイントを整理していきましょう。
なにが起こっているか、一つひとつ順を追って書き出していけば、難しくありません。
ポイント①電解質について覚える
水に溶けると電気を通す物質を電解質といいます。
溶質である金属自身や溶媒である水自身は電流を通さないけれど、電解質の溶けた水溶液は電流を通します。
「水は電流を通さないのに、水の電気分解はなんでできるの?」と思った方は鋭いです。
実は水の電気分解では、電流を通しやすくするために水酸化ナトリウムや硫酸などの電解質が少し溶かされています。
そのため「薄い水酸化ナトリウム水溶液の電気分解」と書かれていたら、水の電気分解の問題なので注意しましょう。
よく出てくる電解質としては塩酸、塩化銅などが挙げられます。
ではなぜ、電解質が水に溶けると電気を通すのでしょうか?
ポイント②電離について覚える
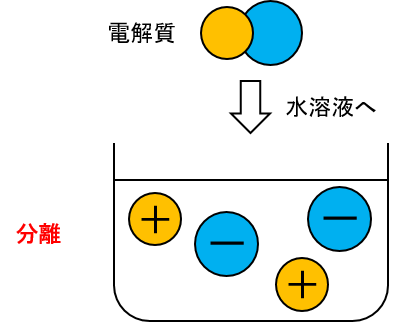
それは、電解質が水溶液中で電離(イオン化)するからです。
物質が水に溶けて陽イオンと陰イオンに分かれることを電離といいます。
電離について押さえるには、この陽イオンと陰イオンについて学ぶことが必要です。具体的にそれぞれどのようなものなのでしょうか?
陽イオンと陰イオンについて
原子が電子を失って+に帯電したものを陽イオン、原子が電子を受け取って−に帯電したものを陰イオンといいます。
もともと電気的に中性だった物質が陽イオンと陰イオンに分かれるので、電離を表した化学反応式は必ず、
[水に溶かした物質] → [陽イオン] + [陰イオン]
の形になります。
電解質ごとの電離式
ポイント①で挙げた電解質について、どのように電離するかを表にまとめました。
近年の入試にも出てきた電解質なので、しっかり覚えておきましょう。
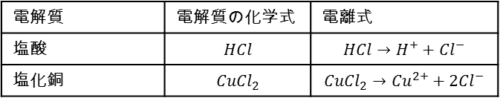
ちなみに、化学式の読み方ルールに従うとHClは「塩化水素」ですが、塩化水素の水溶液を「塩酸」と呼びます。
電気分解では電解質の溶けた水溶液を電気分解するので、「塩酸」という呼び名で出てきます。
ポイント③電圧を加えるとどうなるか?
電解質が電離した状態の水溶液に、電源装置や電池をつないで電圧を加えると、何が起こるのでしょうか。
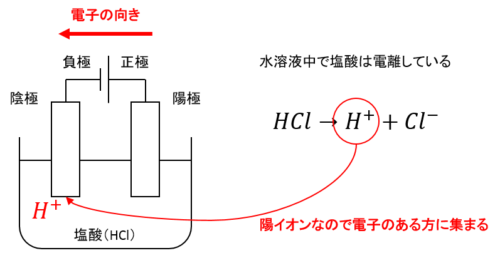
水溶液に浸した電極のうち、電源の負極と接続するものを陰極、正極と接続するものを陽極と呼びます。
電流は正極から流れ、電子の流れは電流と逆向きなので、陰極には電子が集まりーに帯電し、陽極は電子がいなくなるので+に帯電します。
文章だけだと、何が何だかわかりにくいですよね。
これを図に描くと以下のようになります。
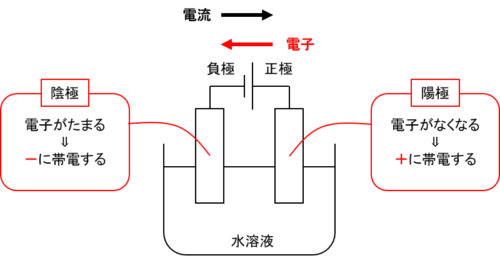
いかがでしょう、図にすると一気にわかりやすくなりませんか?
いま電極はどちらも帯電していますね。
このうち陰極のーを打ち消そうと陰極に陽イオンが集まり、陽極には陰イオンが集まるのです。
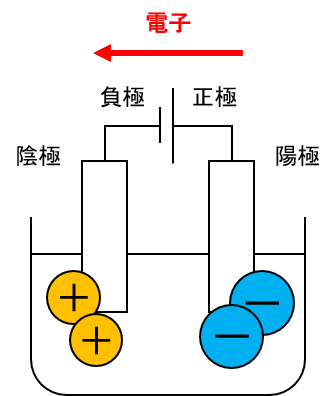
陰極はーに帯電するから陽イオン、陽極は+に帯電するから陰イオン…とだけ覚えようとするとややこしくなってしまいます。
そのため電子の動きを理解しながら図に書く練習をしましょう。
ポイント④化学反応式にまとめる
水溶液中で何が起こっているかわかったら、それを化学反応式にまとめましょう。
この化学反応式まで書ければ、電気分解は解けたも同然です。
塩酸の場合、水素イオンが2つ集まって水素分子に、塩化物イオンが2つ集まって塩素分子になります。
まず電離式を見てみましょう。
![]()
電離式には水素イオンも塩化物イオンも1つずつしかないので、両辺を2倍にします。
![]()
水素イオンが電子を受け取って水素イオンに、塩化物イオンが電子を失って塩素分子になります。
そのため最終的に塩酸の電気分解の化学反応式は
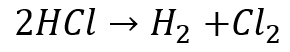
となります。
ここまでポイントが整理できていれば、もう大丈夫です。
実際にどのような問題が出題されるのか?
それでは実際の入試問題を解いてみましょう。
都立高校入試では、電気分解は頻出の分野であり、大問として出題されることも多いです。
以下の問題は、令和2年度都立高校入試、大問1の問2です。
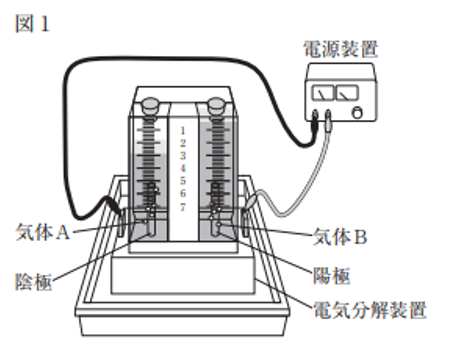
“図1のように、電気分解装置に薄い塩酸を入れ、電流を流したところ、
塩酸の電気分解が起こり、陰極からは気体Aが、陽極からは気体Bがそれぞれ発生し、
集まった体積は気体Aの方が気体Bより多かった。
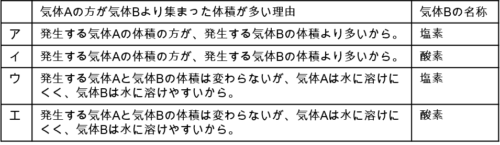
気体Aの方が気体Bより集まった体積が多い理由と、気体Bの名称との
組み合わせたものとして適切なのは、次の表のア~エのうちではどれか。”
では、解いていきましょう。
図1から必要な情報を書き出していきます。水溶液の種類は本文からわかります。
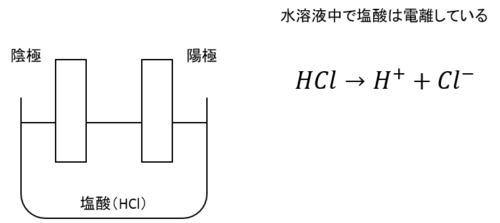
電源装置の正極と負極がどちらであるかは図からはわかりませんが、ポイント③で「電源の負極と接続するのが陰極、正極と接続するのが陽極」と学びましたよね。
つまり、陰極とつながっているのが電源の負極、陽極とつながっているのが電源の正極です。
電流は正極から流れますが、電子の動きは電流と逆向きなので、負極から電子が動きます。
この電子の動く向きが重要です。
電子の向きがわかったことで、陰極に集まるのは水素イオンだとわかります。
そして、残った塩化物イオンが陽極に集まります。
よって、陰極から発生する気体Aは水素、陽極から発生する気体Bは塩素です。
この時点で、選択肢はアとウに絞られました。
アとウの違いは、気体Aと気体Bの体積が同じか異なるかです。
では、電子を受け取ったあとの化学反応式まで書いてみましょう。

化学反応式を見れば、気体A(水素)と気体B(塩素)が同じ体積なのは一目瞭然ですね。
よって、正解の選択肢はウです。
気体A(水素)は水に溶けにくく、気体B(塩素)は水に溶けやすいという説明文も、気体の特徴と合致します。
電気分解の勉強方法について
過去問を解いてみて、問題文から必要な情報を書き出す重要さがわかったのではないでしょうか。
面倒に思えても図を描いて、電子の動きをイメージして、化学反応式にまとめる。
この手順を丁寧に踏めば答えは導き出せるし、ミスも防げます。
電気分解の直前対策法!
出題される電解液の種類はそう多くないので、近年出題された電解液を確実に覚えておきましょう。
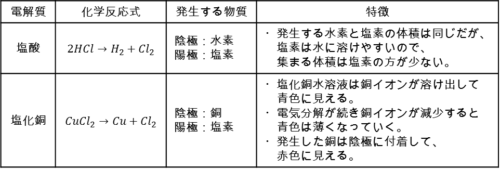
いずれも陽極から塩素が発生するので「プールのようなにおいがする」ことも特徴です。
見た目やにおいなどの特徴も合わせて覚えておけばばっちりです!
まとめ
頭の中だけで考えたり暗記で乗り切ろうとしたりすると難しい電気分解。
だからこそ、面倒に思えても図と化学反応式を書くことが重要です!
情報を「見える化」して、電気分解を得点源にしましょう!














