質量保存の法則はどんな物質の変化についても成り立つ法則なので、いろんな化学変化の問題と組み合わせて出題されることが多いです。
大問で出されることもよくあるので、この記事でしっかりポイントを押さえましょう!
質量保存の法則とは
「反応の前後で質量の総和は変わらない」という法則を、質量保存の法則といいます。
この法則は化学反応だけにあてはまるものではなく、物質に起こるすべての変化について成り立ちます。
- 気体から液体、液体から固体といった状態変化
- 食塩などを水に溶解させた場合
こういった変化についても、質量保存の法則は成り立ちます。
質量保存の法則を理解する上で覚えておきたいポイント!
概要がつかめたところで、ここからは質量保存の法則を理解するために押さえておきたいポイントをご紹介します。
- ポイント①原子の性質をおさらいしよう
- ポイント②化学反応したときの原子の性質を考えよう
- ポイント③質量保存の法則を確認する
- ポイント④質量保存の法則が成り立たないように見えることがある!
- ポイント⑤化合する物質の質量の割合は決まっている!
では、順番に見ていきましょう。
ポイント①原子の性質をおさらいしよう
質量保存の法則は物質の変化に関係するものなので、物質を構成する一番小さな単位、原子の性質を振り返ってみましょう。
〜原子の性質〜
(1)原子はそれ以上分けられない
(2)原子はなくなったり、新しくできたり、ほかの種類に変わったりしない
(3)原子にはその種類ごとに決まった質量がある
この中で今回重要なのは(2)と(3)です。それは何故なのでしょうか?次で詳しく考えていきます。
ポイント②化学反応したときの原子の性質を考えよう
では先ほどの原子の性質を、化学反応したときにあてはめて考えてみましょう。
原子の性質(2)は、反応の前後で原子の数と種類は同じであるという意味です。
ここでは例として、マグネシウムの燃焼を考えてみましょう。
燃焼は酸素と化合する反応なので、化学反応式は次のとおりです。

これを原子のモデル図で表すと次のようになります。

化学反応の前後で原子の結びつき方は変わるけれど、出てくる原子の種類と数は一緒ですね。
これと原子の性質(3)を合わせて考えると「反応の前後で原子の数と種類と質量の総和が同じである」という意味になります。
化学反応の前後では「原子の組み合わせ」が変わるだけなので、質量の総和は同じ。
これが質量保存の法則が成り立つ理由です。
ポイント③質量保存の法則を確認する
では、他の化学反応でも質量保存の法則が成り立っていることを確認しましょう。
銅の燃焼
銅の燃焼は次のように表せます。
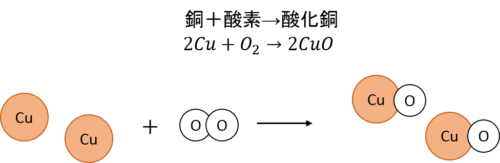
この場合も化学反応の前後で原子の組み合わせが変わっただけなので、質量保存の法則が成り立っています。
硫酸+塩化バリウムの化学反応
硫酸の入った容器に塩化バリウム水溶液を加えていくと、溶液は白くにごります。
この化学反応式は次のとおりです。

だんだん、モデル図がなくても登場する原子の数と種類が同じだとすぐわかるようになってきたのではありませんか?
ポイント④質量保存の法則が成り立たないように見えることがある!
どんな変化にも質量保存の法則は成り立つはずなのに、「質量保存の法則が成り立たないように見える」化学変化もあります。
ここでは、質量保存の法則が成り立たないように見える例をご紹介します。
質量が増えたように見える場合
スチールウール(鉄)の燃焼反応は、質量が増えたように見える一例です。
燃焼は酸素との化学変化なので、空気中の酸素と結びついた分、質量は増加して見えます。
質量が減ったように見える場合
同じ燃焼反応でも、炭を燃やした場合は二酸化炭素が発生して逃げるので質量は減ったように見えます。
他にもよく出題される、質量が減ったように見える例があります。
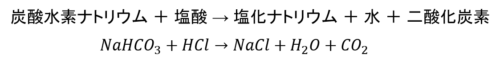
物質の種類は2種類が3種類に増えているし、質量が減ることはないように思えます。
しかし反応後にできた物質をよく見てみると、気体である二酸化炭素がありますね。
この二酸化炭素が空気中に逃げたことで、質量が減ったように見えるのです。
さらにそのあと水を蒸発させると、塩化ナトリウムの結晶だけが残ります。

この文言に注意しよう!
問題文の中に「ふたがあるとき/ないとき」「容器の中で」といった言葉があるかどうかよく読んで、質量保存の法則が成り立っているように見えるかどうか見極めましょう。
ここまで見てきた例では、どちらも周りにある空気との気体のやり取りがありました。
同じ化学変化でも、空気中に気体が逃げないように気体を閉じ込めれば質量保存の法則は成り立ちます。
つまり、「閉じた容器などの中でしか質量保存の法則は成り立たない」ことに注意する必要があるのです。


ポイント⑤化合する物質の質量の割合は決まっている!
ポイント③で取り上げた銅の燃焼について、より詳しく見ていきましょう。
酸素は空気中にたくさんありますが、一定量の銅と化合する酸素の質量には限界があります。
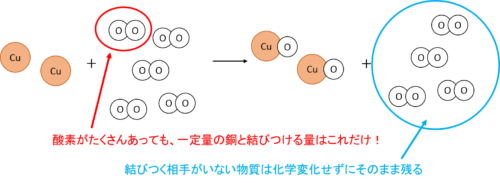
そのためどんなに加熱回数を増やしても、一定量の銅を加熱した後の全体の質量はどこかで頭打ちになります。
一方、銅の質量と出来上がった酸化銅の質量、化合した酸素の質量と銅の質量は比例することもモデル図からわかります。
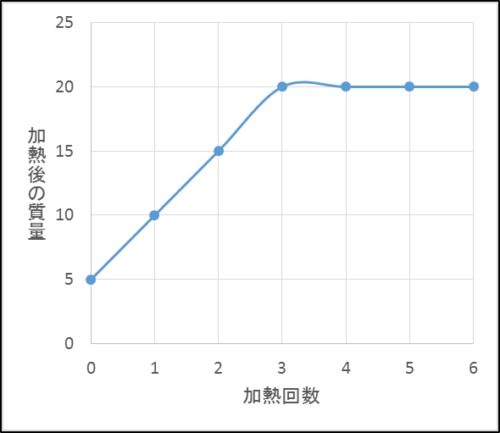
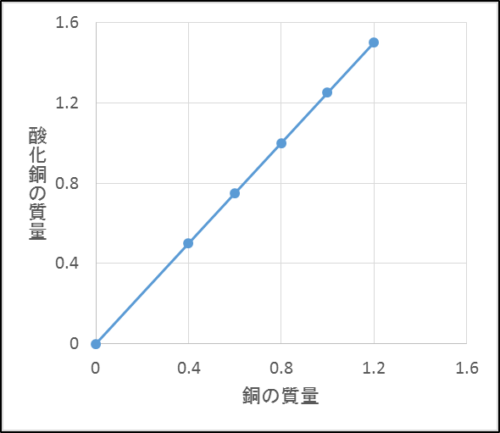
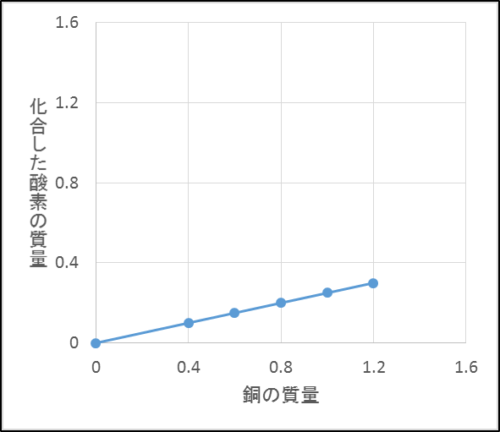
ここで、真ん中と下のグラフはどちらも比例しているけれど、傾きが違うことに注意しましょう。
これは銅の質量と酸素の質量の比が4:1だからです。
つまり銅が4gあるとき化合できる酸素の最大質量は1gで、その反応によってできる酸化銅は最大5gです。
「銅4gと化合する酸素の最大質量を求めよ」といった問題もよく出されるので、比例計算もできるようにしておきましょう。
実際にどのような問題が出題されるのか?
それでは実際の入試問題を解いてみましょう。
以下の問題は、平成31年度都立高校入試の大問5から抜粋したものです。
“銅と酸化銅を用いて次の実験を行ったところ、表のような結果になった。
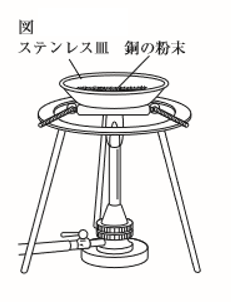
(1)ステンレス皿の質量を電子てんびんで測定すると32.86gであった。このステンレス皿に銅の粉末を0.40g載せ、加熱する前の粉末とステンレス皿を合わせた質量(全体の質量)を測定した。
(2)図のように、銅の粉末を薬さじで薄く広げた後、粉末全ての色が変化するまで十分に加熱した。
(3)ステンレス皿が十分に冷めてから、加熱した後の全体の質量を測定した。
(4)質量が変化しなくなるまで(2)と(3)の操作を繰り返し、加熱した後の全体の質量を測定して、化合した酸素の質量を求めた。
(5)銅の粉末の質量を、0.60g、0.80g、1.00g、1.20gに変え、それぞれについて(1)~(4)と同様の実験を行った。

では、早速解いていきましょう。
いまステンレス皿にふた等はのっていないので、空気中から酸素がたくさん供給されることがわかります。
そして酸素がいくらたくさんあっても、一定量の銅と反応できる酸素の量は決まっています。
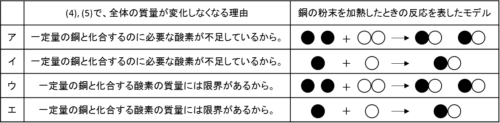
よって(4), (5)で全体の質量が変化しなくなる理由は「一定量の銅と化合する酸素の質量には限界があるから」となり、選択肢はウかエに絞られます。
次に、酸素は空気中で2つの原子が結びついた状態で存在しているので、正しい反応モデルはアかウですね。
よって、正解の選択肢はウです。
実はこの問題の続きには「実験結果から、銅の粉末の質量と化合した酸素の質量の関係を、解答用紙の方眼を入れた図に・を用いて記入し、グラフをかけ」という設問もあります。
ポイント⑤で見てきたようなグラフが書けるか確認しておきましょう。
質量保存の法則の勉強方法について
問題の感覚がつかめたところで、勉強方法をまとめましょう。
原子の組み合わせの変化を書き出す!
化学反応式や模式図を書いて、化学反応の前後で原子の組み合わせがどのように変化したかイメージしましょう。
「あくまでも反応の前後では組み合わせが変わるだけ」と覚えておきましょう。
質量保存の法則の直前対策法!
それでは具体的に、質量保存の法則の直前対策としてどのようなことに取り組めば良いのでしょうか?
問題文をよく読む!
質量保存の法則が成り立っていないように見える場合があることを学んできました。
そのため、以下のような内容が書かれていないか注意しながら問題文をよく読むことが大切です。
- 反応してできた物質が気体なのか、沈殿するものなのか。
- 実験のとき容器は閉じているか、沈殿した物は取り出しているか。
図や化学反応式の中で、質量を測る物質を〇で囲むなどして間違えないように気をつけましょう。
まとめ
質量保存の法則がばっちり理解できたでしょうか?
どんな変化でも成り立つけれど、法則が成り立っていないように見えることがある。
そのことをしっかり頭に入れて入試に臨みましょう!














