中学理科の化学分野、最後の単元である中和。
最後の難関ともいえる中和は、高校入試でも配点の高い問題がよく出されます。
最後まで気を抜かず、着実に理解を深めて得点源にしましょう!
中和とは
酸とアルカリがおたがいの性質を打ち消し合うことを「中和」といいます。
中和反応を式で表すと、次のようになります。
酸+アルカリ→塩+水
中和反応によって塩(えん)と水ができることはぜひ覚えておきましょう。
中和を理解する上で覚えておきたいポイント!
概要がつかめたところで、ここからは中和を理解するために押さえておきたいポイントをご紹介します。
- ポイント①酸とアルカリをおさらいしよう
- ポイント②酸とアルカリを混ぜると発生するものを覚えよう
- ポイント③酸とアルカリを混ぜたときの様子をイメージしよう!
- ポイント④よく出る中和反応と塩をおさえよう
では、順番に見ていきましょう。
ポイント①酸とアルカリをおさらいしよう
酸とアルカリは、次のように電離する物質のことでしたね。
酸→水素イオン+陰イオン
アルカリ→陽イオン+水酸化物イオン
物質が酸性、中性、アルカリ性のいずれであるかを確かめる方法はいくつかあるので、表にして整理してみましょう。
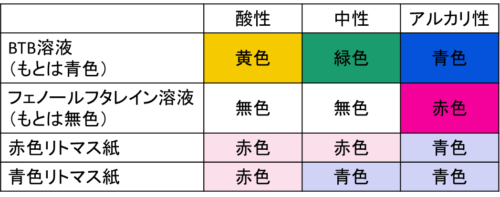
カラフルでややこしい気もしますが「アルカリ性はフェノールフタレインだけ赤色で、他は青になる!」というように自分なりに工夫して覚えておきましょう。
ポイント②酸とアルカリを混ぜると発生するものを覚えよう
酸とアルカリの電離の様子がわかったところで、酸とアルカリを混ぜるとどうなるか考えていきましょう。
先ほどの電離の式をもう一度見てみましょう。
酸→水素イオン+陰イオン
アルカリ→陽イオン+水酸化物イオン
このうち、酸の水素イオンとアルカリの水酸化物イオンが結びついて、水が生成します。
そして、酸の陰イオンとアルカリの陽イオンが結びついた化合物ができます。
この化合物を塩(えん)といいます。
ポイント③酸とアルカリを混ぜたときの様子をイメージしよう!
ここでは、ポイント②の反応の様子を図でイメージしていきましょう。
見た目でわかりやすいよう、BTB溶液を使って可視化します。
模式図でイメージしよう
塩酸に少しずつ水酸化ナトリウム水溶液を加えたときの様子を図に表すと以下のようになります。
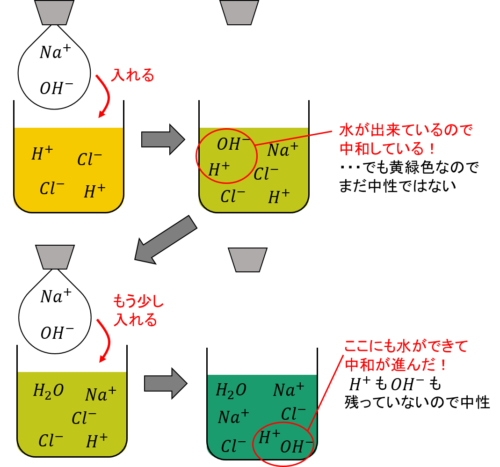
黄緑色の時点ではまだ酸性ですが、このときも中和は起こっています。
つまり「中和=完全に中性になること」ではなく、反応前と比べて性質を打ち消し合っていれば「中和している」と言えるのです。
そのため黄緑色の段階でも中和は起こっているし、塩は生成しています。
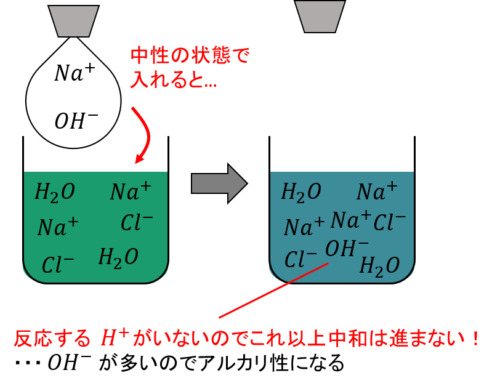
ただし、この状態でさらに水酸化ナトリウム水溶液を加えても、反応する相手がいないのでそれ以上中和は起こりません。
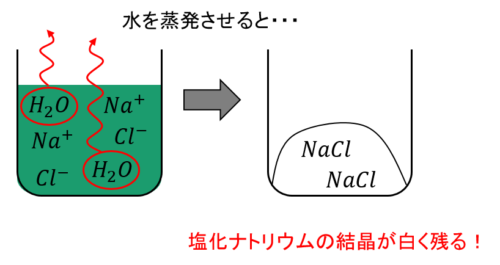
また、中和によって発生した水を蒸発させると塩化ナトリウムの結晶が白く残ります。
化学反応式にまとめよう
先ほど図で示した反応を化学反応式にすると、次のようになります。
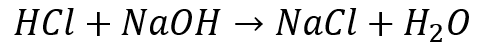
「化学反応式で表せ」という問題もよく出るので、書けるようにしておきましょう。
ちなみにこの化学反応でできる塩、塩化ナトリウムは水に溶ける性質があります。
ポイント④よく出る中和反応と塩をおさえよう
他にも中和反応と塩の例には次のようなものがあります。
・炭酸水と水酸化カルシウム
![]()
この反応でできる塩、炭酸カルシウムは白く沈殿します。
・硫酸と水酸化バリウム
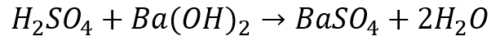
この反応でできる塩、硫酸バリウムも水に溶けず沈殿します。
実際にどのような問題が出題されるのか?
それでは実際の入試問題を解いてみましょう。
以下の問題は、平成28年度都立高校入試の大問5から抜粋したものです。
“次の実験を行ったところ、<結果>のようになった。
(1)薄い塩酸をビーカーA、ビーカーBに10㎤ずつ入れ、それぞれにBTB溶液を加えた。
(2)薄い硫酸をビーカーC、ビーカーDに10㎤ずつ入れ、それぞれにBTB溶液を加えた。
(3)薄い水酸化ナトリウム水溶液と薄い水酸化バリウム水溶液をそれぞれ100㎤用意した。
こまごめピペットを用いて、薄い水酸化ナトリウム水溶液をビーカーAとビーカーCに、薄い水酸化バリウム水溶液をビーカーBとビーカーDに、それぞれのビーカー内の水溶液をよくかき混ぜ、観察しながら、水溶液が緑色に変化するまで少しずつ加えた。
(4)(3)において、水溶液が緑色に変化するまで加えた、薄い水酸化ナトリウム水溶液の量と
薄い水酸化バリウム水溶液の量をそれぞれ記録した。
<結果>
実験の(3)を行った後のビーカーA~Cの水溶液は透明であり、ビーカーDの水溶液は濁った。しばらくするとビーカーDの底に白い沈殿物を確認することができた。また、ビーカーA~Dの水溶液が緑色に変化するまで加えた、薄い水酸化ナトリウム水溶液の量と薄い水酸化バリウム水溶液の量は、次の表のようになった。

P 化学変化で生じた塩が、水に溶けやすい物質であるため。
Q 化学変化で生じた塩が、水に溶けにくい物質であるため。
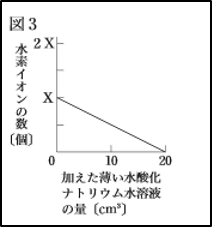
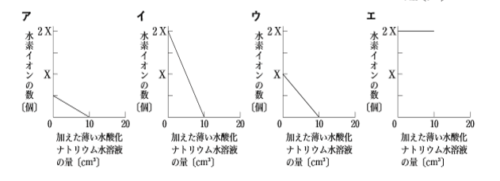
この図と<結果>から、実験の(3)でビーカーCに加えた薄い水酸化ナトリウム水溶液の量と、ビーカーCの水溶液中の水素イオンの数の変化を表したグラフとして適切なのは、次のア~エのうちではどれか。”
では、早速解いていきましょう。
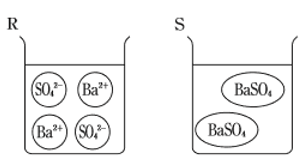
[問1] ビーカーDの底に白い沈殿物を確認することができたと書いてあるので、ビーカーDにできた塩は水に溶けにくいものだとわかります。水に溶けにくいということは、その塩は水溶液の中で電離せずに化合したままです。
よって、正解はQとSになります。
[問2] ビーカーAには薄い塩酸が入っており、そこに薄い水酸化ナトリウム水溶液を加えるので、化学反応式は次のようになります。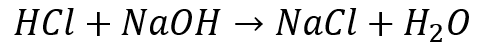
つまり、水酸化ナトリウム水溶液のもつ水酸化物イオンとくっついた水素イオンの数は、ビーカーCではビーカーAの半分だったということです。
よって、水酸化ナトリウム水溶液を加えていないときの縦軸の値がX/2から始まり、水酸化ナトリウム水溶液を加えるにつれて水素イオンの数が減っているアが正解です。
塩酸と硫酸の電離だけを考えて「同じ体積だからビーカーCもX個!」とか「同じ体積でも、硫酸には水素イオンが2個あるから2Xかな?」と考えると間違えてしまうので、注意しましょう。
中和の勉強方法について
問題の感覚がつかめたところで、勉強方法をまとめましょう。
酸とアルカリの電離を図と化学反応式にしよう
中和で大切なのは「酸とアルカリが結びついてなにが発生するのかがわかる」ことです。
そのためには、酸とアルカリが電離してどんなイオンができたのか、図と化学反応式を書いて整理しましょう。
中和の直前対策法!
それでは具体的に、中和の直前対策としてどのようなことに取り組めば良いのでしょうか?
よく出る中和反応をおさらいする!
ポイント④を見直して、よく出題される水溶液の中和反応をおさらいしておきましょう。
BTB溶液とリトマス紙の色を確認しておく!
酸性かアルカリ性かを判断するためによく使われるのがBTB溶液とリトマス紙、フェノールフタレイン溶液です。
色の変化で酸性かアルカリ性か見極められるよう、ポイント①の表をしっかり覚えておきましょう。
まとめ
いかがでしたか?
中学化学の集大成ともいえる「中和」をしっかり理解して、総仕上げにかかりましょう!














