「酸化って酸性になること・・・?」
「還元?濃縮還元ジュースなら聞いたことあるけど・・・」
言葉のイメージだけで捉えようとすると難しくても、一度きちんと理解してしまえば着実に得点にできるのがこの分野です。
この記事でポイントを整理して「酸化還元」をバッチリ説明できるようになりましょう!
酸化還元とは
酸化還元とは、「酸化反応」と「還元反応」を合わせて指す言葉です。
酸素と結びつく化学変化を酸化、その逆で酸素を奪う化学変化を還元といいます。
1つの化学変化の中で酸化と還元は同時に起こるので、両方を合わせて「酸化還元」と呼びます。
中学内容の「酸化還元」を理解する上で覚えておきたいポイント!
概要がつかめたところで、ここからは酸化還元を理解するために押さえておきたいポイントをご紹介します。
- ポイント①酸化とは
- ポイント②還元とは
- ポイント③よく出題される酸化還元反応
- ポイント④酸化と還元は同時に起こる!
- ポイント⑤注意したい化学反応
では、順番に見ていきましょう。
ポイント①酸化とは
酸化とは、酸素と化合する化学反応のことです。
そして、この酸化によってできる物質を酸化物といいます。
中1までの範囲で、木やろうそく、砂糖や小麦粉が燃えることを学びました。
ものが燃えるときに起こっている反応を燃焼と言いましたね。
でも、料理に使う鍋やフライパンは火にかけても燃えません。
またこうした身の回りで使われている金属にはさびるものもあります。
さびる金属の代表例は銅で、特徴的な色をしているため緑青(ろくしょう)と呼ばれます。
さびると一般に もろく なるので、塗装などによって酸素と触れないようにして金属を利用しています。
これらは見た目は違えど「空気中の酸素と結び付いた反応」である点は共通です。
このように、酸素と結び付く反応を酸化といいます。
そのため、燃焼とは「熱や光をともなうはげしい酸化」で、燃焼と比較してさびを「穏やかな酸化」と言ってもよいでしょう。
つまり、燃焼も金属がさびるのも、どちらも酸化の一種です。
ポイント②還元とは
酸素とくっつく化学変化があるなら、きっと逆もありますよね。
それが還元で、酸化物から酸素を奪う化学反応のことを指します。
還元反応は馴染みがないように思えますが、実は身の回りでたくさん行われています。
酸素は大気中にたくさんあるので、自然界で金属はほとんど酸化物として存在します。
ここから金属単体を取り出して利用するために行われるのが、還元反応です。
ポイント③よく出題される酸化還元反応
ここで入試問題によく取り上げられる酸化還元反応をいくつか見てみましょう。
- 酸化銅 + 炭素 → 銅 + 二酸化炭素
- 酸化銅 + 水素 → 銅 + 水
- 二酸化炭素 + マグネシウム → 炭素 + 酸化マグネシウム
- 酸化鉄+炭素(コークス)→鉄+二酸化炭素
それでは、順番に詳しく見ていきましょう。
(1)酸化銅 + 炭素 → 銅 + 二酸化炭素
これは酸化銅を炭素で還元する酸化還元反応です。
登場する物質名が「酸化〇〇」のときはわかりやすいですね。
化学反応式と反応のモデル図は次のとおりです。
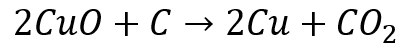
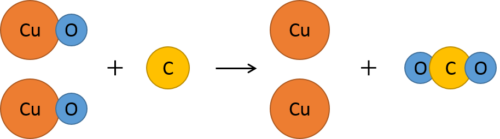
ここで、酸素の受け渡しに注目してみましょう。
酸化銅から酸素が奪われ、その酸素が炭素と結び付いて二酸化炭素になっています。
酸素が奪われた酸化銅は単体の銅になっています。
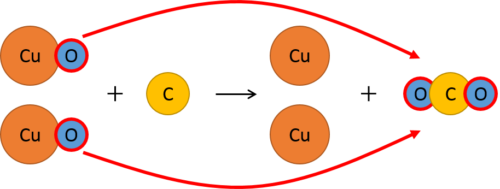
これをまとめると、次のようになります。
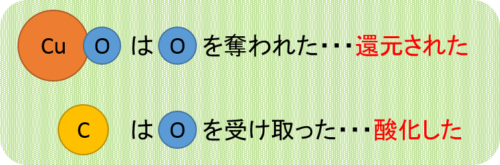
このように注目する物質によって「還元された」か「酸化した」かは異なります。
(2)酸化銅 + 水素 → 銅 + 水
続いても酸化銅の還元反応ですが、こちらは炭素ではなく水素との反応です。

今度は自分でモデル図をイメージしながら考えてみましょう。
酸化銅から酸素が奪われ、その酸素が水素と結びついて水になります。
酸素が奪われた酸化銅は単体の銅になっています。
この場合、還元された物質は酸化銅で、酸化した物質は水素です。
このように、還元された物質と酸化した物質は「いずれも化学反応前のもの」であることを押さえておきましょう。
つまり、化学反応式の右側に出てくる物質は、あくまで酸化還元が起こって生成した物質です。
(3)二酸化炭素 + マグネシウム → 炭素 + 酸化マグネシウム
次は、二酸化炭素とマグネシウムの酸化還元反応です。
(1)では反応後の生成物として登場した二酸化炭素が、今度は反応に使われる側です。
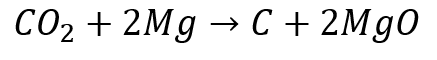
これも同様に考えていけば難しくありません。
二酸化炭素はマグネシウムと反応して酸素を奪われているので「還元された」物質であり、酸素を受け取ったマグネシウムが「酸化した」物質です。
(4)酸化鉄+炭素(コークス)→鉄+二酸化炭素
こちらは還元反応の実用的な例としてよく取り上げられるものです。
自然界に酸化物の状態で存在している金属から酸素を取り除くことで、金属単体を取り出して利用している代表例です。
化学反応式は高校レベルの発展的な内容になるのでここでは解説しませんが、酸化鉄の還元は身の回りで行われている酸化還元反応の具体例としてよく挙げられるので覚えておきましょう。
ポイント④酸化と還元は同時に起こる!
ここで大切なことは「1つの化学変化の中で酸化と還元は同時に起こっている」ということです。
ポイント③で見た酸化還元反応を、炭素に注目して見てみましょう。
(1)や(2)では炭素が酸化されて二酸化炭素が発生しましたが、(4)では二酸化炭素が還元される側になっています。
相手が銅や鉄であれば炭素の方が酸化されやすく、相手がマグネシウムであれば炭素の方が酸化されにくいということです。
このように、物質によって酸素との結びつきやすさは決まっています。
例えば、炭素、銅、鉄、マグネシウムであれば、酸素との結びつきやすさはマグネシウム>炭素>銅や鉄という順になります。
反応する相手によって酸化されるか還元されるかの役割は変化しうるということです。
「この物質が出てきたら必ず酸化される(還元される)」と覚えてしまうのではなく、きちんとそれぞれの物質に注目して考える習慣をつけましょう。
ポイント⑤注意したい化学反応
一見酸化還元反応のように見えて、実はそうでない化学反応もあります。
銅+酸素→酸化銅(銅の燃焼)
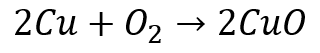
酸化銀 → 銀 + 酸素(酸化銀の熱分解)
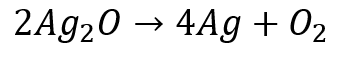
これらの化学反応には酸素が出てくるので、酸化還元反応だと思ってしまいがちです。
しかし、銅は酸素を受け取っているけれど、酸素を失っている物質はありません。
酸化銀は酸素を奪われているけれど、酸素を受け取っている物質はありません。
酸化還元反応とは、酸素を受け取る物質と酸素を奪われる物質の両方が含まれている化学反応です。
しかし、今回挙げた反応はあくまで「酸化のみ」の反応や「分解」といった酸素を離す反応でしかないため、酸化還元反応とは異なります。
このように、酸素が含まれる化学反応が必ずしも酸化還元反応ではないことに注意しましょう。
高校入試の「酸化・還元」範囲では実際にどのような問題が出題されるのか?
それでは実際の入試問題を解いてみましょう。
以下の問題は、平成31年度都立高校入試の大問5から抜粋したものです。
“<実験2>
(1)酸化銅1.00gと十分に乾燥させた炭素の粉末0.06gをよく混ぜ合わせ,乾いた試験管Aに入れ,ガラス管がつながっているゴム栓をして,図2のように試験管Aの口を少し下げ,スタンドに固定し,ガラス管の先を石灰水の入った試験管Bに入れた。
(2)試験管Aをガスバーナーで加熱したところ,ガラス管の先から気体が出ていることと,石灰水の色が白く濁ったことが確認できた。
(3)ガラス管の先から気体が出なくなったことを確認した後,ガラス管を石灰水の中から取り出してから試験管Aの加熱をやめ,ゴム管をピンチコックで閉じた。試験管Aが十分に冷めてから,試験管Aに残った物質を取り出し質量を測定した後,観察した。
<結果2>
試験管Aに残った物質の質量は0.84gであった。赤色の物質と黒色の物質が見られた。赤色の物質を薬さじで強くこすると,金属光沢が見られた。
〔問3〕<結果2>から分かる,酸素と銅や炭素との結び付きやすさの違いと,試験管Aで還元される物質を組み合わせたものとして適切なのは,次の表のア〜エのうちではどれか。”

では、早速解いていきましょう。
問題文中に「還元」という文字が見られるように、これは酸化銅と炭素の酸化還元反応の問題です。
酸化銅と炭素の酸化還元反応はポイント③でも取り上げましたが、化学反応式は次のようになります。
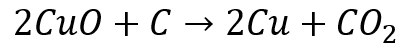
<実験2>(2)において石灰水の色が白く濁ったことから、反応後に二酸化炭素ができていることが確認できます。
また、<結果2>から試験管Aに残った赤色の物質は銅だとわかります。
つまり「酸素は銅よりも炭素と結び付きやすい」ので、選択肢はアかイに絞られます。
初めから銅と結び付いていたので銅の方が結び付きやすいと考えてしまうかもしれませんが、そうではありません。
加熱して自由に動けるようになった酸素は銅でなく炭素と結び付くことを選んだと考えてみましょう。
還元される物質は化学反応前の物質なので「酸化銅」となり、答えはアとなります。
高校入試「酸化還元」の勉強方法について
問題の感覚がつかめたところで、勉強方法をまとめましょう。
それぞれの物質に着目して考えよう
酸化と還元は同時に起こるので、着目する物質によって酸化されているか還元されているかは異なります。
ポイント③で挙げた例の中で酸化している物質はどれで、還元している物質はどれか答えられるようにしておきましょう。
酸化還元の直前対策法!
それでは具体的に、酸化還元の直前対策としてどのようなことに取り組めば良いのでしょうか?
他の問題と組み合わせて解けるようにする!
酸化還元は他の化学反応と組み合わせて出題されることも多く、大問での出題もよく見られます。
特に、燃焼、質量保存の法則、分解や中和反応と比較した物質の同定などは一緒に出題されやすいです。
自分に合った問題集などでよく練習しておきましょう。
まとめ
酸化還元について理解できたでしょうか?
酸化還元反応は単体ではもちろん、他の化学反応と組み合わせての出題も多い分野です。
ここを得意分野にできれば、高得点を稼ぐことができます。
焦らずに一歩ずつ、しっかり理解を深めていきましょう!














